Untuk soal yang berkaitan dengan pereaksi pembatas, menentukan
terlebih dahulu zat yang bertindak sebagai pereaksi pembatas, yaitu jika
jumlah mol pereaksi yang diketahui dibagi koefisien pada persamaan
reaksi memberikan nilai lebih kecil dibanding pereaksi lainnya, maka
pereaksi tersebut merupakan pereaksi pembatas. Pereaksi pembatas akan
habis oleh sebab itu yang tersisa setelah reaksi berakhir bukan
merupakan pereaksi pembatas dan banyaknya pereaksi lain yang bereaksi
sama dengan jumlah mol pereaksi pembatas.
Beberapa cara konversi
Dari mol ke gram atau dari mol menjadi massa
Dari gram atau dari massa menjadi mol
Mr tidak memiliki satuan yang memiliki satuan massa
molar zat itu jadi ketika akan dikonfersi dari satuan ke satuan yang
lain, yang digunakan adalah massa molar bukan Mr atau Ar. Massa molar
memiliki satuan g/mol.
Contoh Soal
Suatu cuplikan senyawa MgCO3.xCaCO3 direaksikan dengan asam sulfat berlebih manghasilkan MgSO4, CaSO4, H2O dan CO2. Jika dihasilkan 2 mol gas CO2 permol MgSO4, maka berapa nilai x…?
Jawab
Langkah-langkah penyelaesaian
1. Menulis persamaan reaksinya (reaksi belum setara)
MgCO3.xCaCO3 —→ MgSO4 + CaSO4 +H2O + CO2
2. Pada soal 2 mol gas CO2 yang dihasilkan dari setiap mol MgSO4. Maka persamaan reaksinya akan menjadi
MgCO3.xCaCO3 —→ 1MgSO4 + CaSO4 +H2O + 2CO2
3. Berilah koefisien yang sesuai pada x agar jumlah atom diruas kiri
dan kanan sama banyak. (biasanya atom yang langsung berkaitan atau
berhubungan dengan x). Agar jumlah atom setara maka x =1. Pada
reaksi ini sebenarnya telah setara sehingga langkah penyelesaiannya
cukup sampai langkah nomor 2. Namun jika belum setara maka harus
dilanjutkan ke langkah nomor 3.
Contoh soal
Jika 2 g gas H2 direaksikan dengan 8 g gas O2 berapa massa H2O yang dihasilkan…..?
Jawab
Langkah-langkah penyelesaian
1) Menulis persamaan reaksi yang setara:
H2 + 1/2H2 —→H2O
2) Konversikan massa senyawa-senyawa atau pereaksi yang diketahui ke dalam mol
Mol H2 = 2/Mr.H2 = 2/2 = 1 mol
Mol O2 = 8/Mr.O2 = 8/32 = 0,25 mol
3) Menentukan reagen pembatas dengan cara: mol masing-masing spesi
yang telah diketahui dibagi dengan koefisien masing-masing spesies dari
persamaan reaksi.
H2 = 1/1 = 1
O2 = 0,25/0,5 atau 0,25/1/2 = 0,5
Jadi O2 sebagai reagen pembatas karena paling sedikit.
4) Menentukan mol H2O yang dihasilkan menggunakan persamaan:
5) Karena yang ditanya massa H2O maka mol H2O yang telah diketahui dikonfersikan menjadi gram, menggunakana persamaan:
Contoh Soal
Bila serbuk besi 28 gram (Ar Fe = 56) direaksikan
dengan 20 g belerang (Ar S=32). Sesuai persamaan reaksi berikut: Fe + S
→FeS
Dari reaksi yang terjadi tentukan pereaksi manakah yang tersisa setelah reaksi berakhir?
Jawab
Langkah penyelesaian
1. Konversikan massa kedua logam yang telah diketahui dalam satuan mol.
Mol besi = 28 g / 56 g/mol = 0,5 mol
Mol belerang = 20 g / 32 g/mol = 0,6 mol
Dari jumlah mol dari kedua unsur dapat diketahui bahwa apabila jumlah
mol kedua unsur dibagi dengan koefisien masing-masing unsur pada
persamaan reaksi akan diperoleh mol besi lebih kecil dari mol belerang.
Oleh sebab itu yang menjadi pereaksi pembatas dalam reaksi ini adalah
besi.
2. Menentukan mol belerang yang bereaksi. Seperti yang telah
disinggung bahwa pereaksi lain yang bereaksi sama dengan jumlah mol
pereaksi pembatas. Karena besi yang tersedia sebanyak 0,5 mol maka
belerang yang bereaksi adalah 0,5 juga.
3. Jadi massa belerang yang bereaksi = 0,5 mol x Ar S = 0,5 mol x 32 g/mol = 16 g
4. Dan S yang tersisa sebanyak = 20-16 = 4 gram.
Contoh Soal
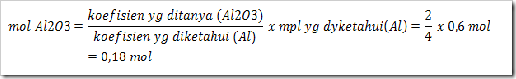
Berapa mol Al2O3 yang terbentuk jika dibentuk dari campuran 0,36 mol Al dengan 0,36 mol oksigen berdasarkan reaksi berikut:
4Al + 3O2 → 2Al2O3
Jawab
soal di atas masih berkaitan dengan pereaksi
pembatas. Oleh sebab itu jika dilakukan perhitungan maka akan diperoleh
mol Al/koefisien Al < mol O2/koefisien O2
maka mol Al sebagai pereaksi pembatas
Contoh Soal
60 g gas etana dibakar secara sempurna dengan 16 g oksigen. Berapa jumlah molekul H2O yang terbentuk…..
a. 1,20 x 1022
b. 2,40 x 1022
c. 2,40 x 1023
d. 3 x 1023
e. 1,20 x 1024
Jawaban C
Langkah-langkah penyelesaian:
1) Tulislah reaksi yang setara dari proses pembakaran jika reaksi
belum disetarakan dan jika reaksi telah diketahui maka harus disetarakan
terlebih dahulu.
Untuk reaksi pembakaran sempurna produk yang dihasilkan hanya CO2 dan H2O sedangkan pemabakaran tidak sempurna produk yang dihasilkan berupa CO dan H2O.
C2H6 + 7/2O2 → 2CO2 + 3H2O
2) Tentukan mol dari masing-masing massa pereaksi yang telah diketahui.
Massa C2H6 = 60 g
mol C2H6 = 60/30 = 2 mol
massa O2 = 16 g
mol O2 = 16/32 = 0,5 mol
3) Dari persamaan reaksi yang telah setara tentukan pereaksi mana yang akan habis terlebih dahulu (pereaksi pembatas).
mol C2H6 / koefisien C2H6 = 2/1 = 1
mol O2/koefisien O2 = 0.5 / 7/2 = 0,143
karena mol O2/koefisien O2 < mol C2H6/koefisien C2H6 maka O2 sebagai pereaksi pembatas.
4) Hitunglah jumlah mol H2O yang dihasilkan. Menggunakan persamaan:
Catatan: Koefisien dan mol yang diketahui disini adalah spesies atau senyawa yang menjadi pereaksi pembatas.
5) Tentukan jumlah molekul yang ditanyakan dengan cara mengalikan mol spesi yang ditanyakan dengan bilangan Avogadro.
Catatan: Dari contoh soal di
atas, jika yang ditanyakan hanya mol produk maka langkah penyelesaian
hanya sampai pada tahap 4. Bagaimana jika yang ditanyakan mol CO2? Untuk CO2 langkah penyelesaian tetap sama seperti di atas tetapi koefisien yang ditanya menggunakan koefisien CO2 bukan koefisien H2O. Tetapi apabila yang ditanyakan adalah volume gas CO2 maka langkah penyelesaian seperti pada soal-soal dibagian bawah.
Contoh Soal
Logam aluminium larut dalam KOH pekat berdasarkan reaksi:
2Al + 2KOH + 6H2O → 2K(Al(OH)4) + 3H2
Berapa volume gas H2 yang dihasilkan pada STP bila 2,7 g aluminum yang dilarutkan….
Jawab
1) Pada soal di atas reaksi telah setara jadi tidak perlu disetarakan
2) Konfersikan massa logam Al yang diketahui ke dalam mol
3) Tentukan mol H2 yang dihasilkan (perhatikan koefisien):
4) Karena reaksi dilansungkan pada keadaan standar maka” satu mol gas gas apa saja memiliki volume 22,4 L. maka
0,15 mol x 22,4 L = 3,36 L
Contoh Soal
Berapa liter gas oksigen yang dibutuhkan untuk membakar 6 liter gas propana secara sempurna…?
a. 150
b. 90
c. 75
d. 30
e. 15
Jawaban D
Langkah-langkah penyelesaian
1. Tulislah reaksi yang setara dari proses pembakaran.
C3H6 + 5O2 → 3CO2 + 4H2O
2. Hitung volume O2 yang dibutuhkan, menggunakan persamaan:
Contoh soal
Perhatikan persamaan reaksi berikut
C3H8(g) + O2(g) → CO2(g) + H2O(g)
Pada suhu dan tekanan tertentu, berpa perbandingan volume CO2 dan H2O……..?
Jawab
Tulislah persamaan reaksi yang setara
C3H8(g) + O2(g) → 3CO2(g) + 4H2O(g)
Berdasarkan hukum Gay Lussac-Avogadro yang menyatakan “pada suhu dan
tekanan tertentu perbandingan koefisien zat-zat yang bereaksi pada fasa
gas sama dengan perbandingan volume zat-zat yang bereaksi”
Jadi perbandingan volume CO2 dan H2O = koefisien CO2:koefisien H2O = 3:4.
Contoh Soal
Perhatikan reaksi berikut:
Mg(s) + 2HCl(aq) → MgCl2(aq) + H2(g)
Jika terdapat 4,8 g logam magnesium (Ar Mg=24) dan HCl berlebih, berapakah liter gas H2 yang dihasilkan pada kondisi standar (STP)…
a. 2,24
b. 4,48
c. 6,72
d. 11,20
e. 22,40
Jawaban
Langkah-langkah penyelesaian:
1) Jika reaksi belum setara, setarakan reaksi yang terjadi dengan
memberi koefisien yang sesuai. Pada reaksi di atas telah setara maka
tidak perlu dilakukan penyetaraan.
2) Konversikan massa logam Mg yang diketahui menjadi mol.
3) Pada reaksi diatas koefisien H2 = koefisien Mg, maka mol H2 = mol Mg = 0,2 mol
4) Hitunglah volume gas H2 yang dihasilkan, dengan cara:
mengalikan mol gas yang ditanyakan dengan 22,4 L. 22,4 merupakan suatu
tetapan dimana 1 mol gas apa saja pada keadaan standar akan memiliki
volume sebesar 22,4 L. Karena pada reaksi terdapat 0,2 mol maka volume
gas H2 yang dihasilkan dapat dihitung dengan cara: 0,2 mol x 22,4 liter/mol = 4,48 L.
Contoh Soal
Di dalam laboratorium gas CO2 biasanya dibuat dengan cara memanaskan padatan KClO3 murni sehingga diperoleh KCl dan O2. Bila pada keadaan standar (STP) volume O2 yang diinginkan adalah sebesar 16,8 L. Berapakah massa KClO3 murni yang dipanaskan…..
Jawab
Reaksi yang setara
2KClO3 → 2KCl + 3O2
VO2 = 16,8 L/mol → mol O2 = 16,8L/22,4L = 0,75 mol
Jadi massa KClO3 murni yang harus dipanaskan sebanyak 61,35 g.
Contoh soal
Reaksi antara KClO3 dengan HCl berkebih adalah sebagai berikut
KClO3 + HCl → KCl + 3H2O + 3Cl2
Berapa gram KClO3 yang dibutuhkan agar diperoleh 142 gram Cl2?. Jika diketahui Ar K = 39, Cl=35,5, O = 16, H = 1.
Jawab
Konfersikan massa Cl2 yg diketahui ke dalam mol
HCl berlebih artinya KClO3 sebagai pereaksi pembatas, maka:
contoh soal
suatu cuplikan besi sebanyak 5 gram dipanaskan dengan
gas klor menghasilkan 10 gram besi(II) klorida. Tentukan persen (%)
unsur besi yang terdapat dalam cuplikan? Jika diketahui Ar.Fe = 56.
Ar.Cl=35,5.
Jawaban
Langkah-langkah penyelesaian
1) Tulislah reaksi berimbang yang terjadi
Fe+Cl2 → FeCl2
2) Konfersikan massa FeCl2 yang diketahui menjadi mol
3) Dari persamaan yang telah berimbang diatas diketahui bahwa
Koefisien Fe = koefisien FeCl2
Pernyataan ini menyatakan
Mol Fe = mol FeCl2. Karena mol FeCl2 telah diketahui maka mol tersebut sama dengan mol Fe, yakni 10/127 mol.
4) Konfersikan mol Fe yang telah diketahui menajdi gram
5) Konfersikan massa Fe ke dalam persen
Sumber : http://wanibesak.wordpress.com/2011/02/22/soal-persamaan-reaksi-dan-pembahasan/


 1:15 AM
1:15 AM
 Unknown
Unknown


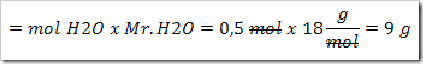

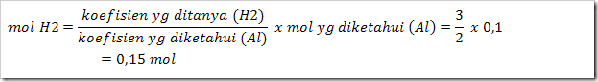

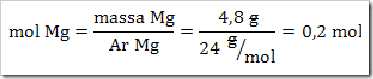




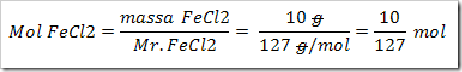
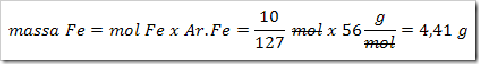
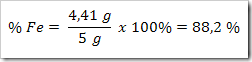











0 comments:
Post a Comment